14 listopada 2024
Jaka przyszłość czeka pszczoły? Czy beewashing zagraża zapylaczom?
Zapylacze pełnią jedną z najważniejszych usług ekosystemowych polegającą na zapylaniu, co umożliwia produkcję żywności. Odpowiadają one za zapylanie około 75% światowych upraw [1]. W Polsce w 2015 roku wartość zapylania świadczoną przez owady dla roślin uprawnych oszacowano na 1,8 mld euro [2]. Naukowcy coraz częściej informują o zmniejszającej się populacji zapylaczy, do której przyczyniają się stosowane w rolnictwie i leśnictwie chemiczne środki ochrony roślin, zmiany klimatyczne, utrata siedlisk oraz konkurencja międzygatunkowa [3]. Co warte podkreślenia, badania naukowe wskazują, że negatywny wpływ na zdrowotność i efektywność zapylaczy wykazują także nawozy sztuczne [4, 5]. Mają one zdolność do zmiany właściwości biofizycznych kwiatów, wpływając na wielkość i dynamikę wysyłanych przez nie sygnałów [4, 6]. Takie same zdolności modyfikowania wykazują insektycydy zakłócające pracę układu nerwowego owadów [7]. Szkodliwy wpływ nawozów sztucznych uwidacznia się także pośrednio: przekształceniu ulega skład florystyczny przenawożonych łąk, prowadząc do zubożenia owadziej bazy pokarmowej [8].
Na wstępie warto zacząć od sklasyfikowania, jakie grupy w skali globalnej zaliczane są do zapylaczy. Poza owadami są to także ptaki, gryzonie, gady, wiewiórki, małpy oraz ludzie. W Europie do czołowych zapylaczy zalicza się owady, a wśród nich: pszczoły, bzygowate, motyle, chrząszcze, ćmy oraz osy, z czego za głównych zapylaczy uznaje się pszczoły. Europa, którą zamieszkuje ponad 2000 dzikich gatunków pszczół, stanowi dom dla 10% ich światowej populacji [9]. W Polsce zidentyfikowano ponad 490 gatunków pszczół. Mimo znacznej różnorodności gatunkowej, najbardziej znanym pozostaje pszczoła miodna Apis mellifera, której przypisuje się kluczową rolę w zapylaniu uprawianych roślin. Badania naukowe poddają wątpliwości tę tezę, wykazując, że działalność pszczoły miodnej jest uzupełnieniem funkcji pełnionych przez dzikie zapylacze, natomiast nie jest w stanie jej zastąpić [10]. Niektóre gatunki roślin cechuje specyficzna morfologia (np. wargowa budowa kielicha kwiatowego u licznych w Polsce przedstawicieli rodziny jasnotowatych Lamiaceae), utrudnia zapylanie, a jednocześnie pobieranie pożytku przez pszczołę miodną z uwagi na jej krótki języczek. Choć próżno szukać w literaturze ogólnego udziału poszczególnych grup owadów w procesie zapylania (bowiem jest on zależny od gatunku rośliny, który rozpatrujemy), za najefektywniej zapylające owady uznawane są trzmiele Bombus, reprezentujące rodzinę pszczołowatych [8]. Ich udział w procesie zapylania poszczególnych gatunków jest zróżnicowany, jednak można wyróżnić gatunki, których istnienie bez trzmieli byłoby zupełnie niemożliwe (np. z rodzaju tojad Aconitum L.) lub ich uprawa byłaby bardzo trudna (koniczyna czerwona Trifolium pratense L.). Inne, których przetrwanie w dużej mierze jest zależne od trzmieli to m.in. wyka Vicia L., w tym: bób, pszeniec Melampyrum L, nasturcja Tropaeolum L., wyżlin Antirrhinum L., czy naparstnica Digitalis L. Interesującym przykładem jest także lucerna Medicago sativa L., która ze względu na „eksplozyjne” otwieranie się kwiatów jest mniej chętnie odwiedzana przez pszczoły miodne. Poza pszczołą miodną na plantacjach lucerny stwierdzono obecność ponad 140 gatunków z rodziny pszczołowatych, wśród nich m.in. miesierkę lucernówkę Megachile rotundata, spójnicę lucernowatą Melitta leporina (Vecht), trzmiele Bombus spp., kornutkę koniczynową Eucera longicornis, pseudowigorczyka lucernowca Rhophitoides canus (Evers.) oraz pszczolinki Andrena spp. [11,12]. Za zapylanie plantacji marchwi odpowiadają zaś w większości muchówki. Co więcej, ich rola wzrasta wraz ze zmianą warunków świetlnych i wilgotnościowych – zarówno dla pszczół, jak i motyli, miejsca ocienione i wilgotne lub bagienne są nieatrakcyjne [13]. Na obszarze tych nisz ekologicznych na znaczeniu jeszcze bardziej zyskują dzikie zapylacze. Ograniczenie stanowią także warunki termiczne, co ma kluczowe znaczenie dla populacji geofitów wiosennych (gatunek, najczęściej bylina, którego kwitnienie rozpoczyna się wczesną wiosną, najczęściej jeszcze przed rozwinięciem liści na drzewach. Do grupy tej zalicza się m.in. ziarnopłon wiosenny, zawilec gajowy i żółty, przylaszczka pospolita oraz różne gatunki miodunki). Rozkwitają one w okresie, w którym obserwuje się dużą dobową zmienność warunków atmosferycznych, a temperatura nie przekracza 10°C przy znacznej wilgotności powietrza. Warunki te uniemożliwiają prace pszczole miodnej, natomiast nie wpływają na działalność zapylającą trzmieli Bombus [14].

Znaczenie dla upraw rolnych ma także wydajność, z jaką pracują owady zapylające, bowiem jest ona jedną ze składowych determinujących wielkość osiąganego plonu [11]. Przeprowadzone badania wskazują, że praca jednego trzmiela Bombus jest równa średnio pracy 4-5 pszczół miodnych Apis mellifera [15]. Wysoką wydajnością, wykorzystywaną często w uprawach sadowniczych, odznacza się także m.in. murarka ogrodowa Osmia rufa, którą cechuje brak agresji wobec człowieka, łatwość hodowli i szybka adaptacja do nowych warunków przy niskich ponoszonych kosztach [14]. Pszczoła miodna nie jest więc w stanie zastąpić owadów dziko zapylających.
Temat zmniejszającej się różnorodności zapylaczy stanowi centrum zainteresowania wielu naukowców, którzy jako główne zagrożenia dla populacji zapylaczy wskazują najczęściej presję człowieka na środowisko. Do największych zagrożeń zalicza się: utratę siedlisk postępującą w wyniku intensyfikacji rolnictwa, zwiększanie obszarów miejskich, zmiany klimatyczne oraz wzrost częstotliwości pożarów [16].
Beewashing
Sytuacji dzikich zapylaczy nie poprawiają praktyki określane mianem beewashingu. Zalicza się do nich działania, które zamiast chronić, oddziałują negatywnie na różnorodność biologiczną owadów zapylających. Fundacja Kwietna nazywa je wprost budowaniem zielonego wizerunku firm, instytucji oraz osób prywatnych za pomocą działań związanych z pszczołami prowadzonych kosztem pszczół lub środowiska naturalnego [17]. Niestety, nie trudno o niechlubne przykłady z naszego podwórka. Jedna z największych polskich firm specjalizująca się w przemysłowym chowie zwierząt, który, co warte podkreślenia, nie pozostaje neutralny ani korzystny środowiskowo, w ramach „dbałości o bioróżnorodność” na tereny ferm przemysłowych wprowadziła… pasieki [18].
Worek beewashingowych praktyk jest pojemny. Zalicza się do nich m.in. koncentrację przede wszystkim na ratowaniu pszczoły miodnej, która nie jest zagrożona wyginięciem, co przyczynia się do dezinformacji wśród opinii publicznej i niewłaściwego użytkowania środków budżetowych przeznaczonych na ochronę [19]. Innym przykładem beewashingu jest zwiększanie liczby pasiek na terenach miast i obszarów chronionych, co przynosi negatywne skutki nie tylko dla populacji dzikich zapylaczy za sprawą zintensyfikowanej konkurencji pokarmowej przy niedostatecznej ilości pożytków, ale także hodowlanych pszczół miodnych, które w zbyt dużych koncentracjach, są bardziej narażone na warrozę – groźną chorobę pasożytniczą wywołaną przez roztocza Varroa jakobsoni [20, 21]. Co więcej, badania dowodzą, że ilość wirusów występujących u trzmieli i pszczół samotnic jest dodatnio powiązany z częstością występowania wirusów u pszczoły miodnej [19, 22]. Statystyki zgromadzone przez kwietna.org są alarmujące; na terenie Warszawy pasiek komercyjnych jest czterokrotnie za dużo, co może oznaczać, że na jednego warszawiaka przypada ok. 185 pszczół miodnych [23]. Wyniki dotychczas przeprowadzonych badań wskazują, że rywalizacja pokarmowa między pszczołami hodowlanymi, a dzikimi może nie tylko ograniczyć liczebność tych drugich, ale także przyczynić się do mniejszego zbioru nasion wynikającego z odmiennej budowy/morfologii i niewystarczającego wyspecjalizowania pszczoły miodnej w zapylaniu niektórych gatunków roślin [24].

(Nie)oczywiste zagrożenia
Nie bez znaczenia dla dzikich zapylaczy zostają także opryski z powietrza stosowane w lasach. Najczęściej są to insektycydy, które cechuje wysoka toksyczność dla człowieka i pozostałych organizmów, a także ich nieselektywność, co sprawia, że działają one na wszystkie bezkręgowce, nie tylko szkodniki [25]. Substancją czynną dwóch z insektycydów stosowanych przez Lasy Państwowe (tj. Mospilan 20 SP oraz Los Ovados) jest acetamipryd należący do grupy neonikotynoidów, przyczyniający się w największym stopniu do spadku liczebności owadów [25, 26].
Stosowanie pestycydów w rolnictwie i ogrodnictwie poza godzinami aktywności pszczół miodnych nie zmniejsza wystarczająco zagrożenia dla populacji dzikich zapylaczy. Niektóre gatunki dzikich pszczół tj. lepiarki, pszczolinki, smuklikowate, spójnicowate i pszczołowate najczęściej jako miejsce gniazdowania wybierają glebę. Stosowanie chemicznych środków ochrony roślin w miejscach ich siedlisk przyczynia się do zmniejszenia ich liczebności, niezależnie od godziny zastosowania oprysku. Kolejne zagrożenie stanowi zmiana sposobu użytkowania gruntów. Znaczna część populacji dzikich owadów zapylających bytuje na terenach ruderalnych, w obrębie muraw kserotermicznych, przydrożnych zadrzewień zlokalizowanych zwłaszcza w zróżnicowanym krajobrazie rolniczym, tworzącym mozaiki pól, a także na uprawach lucerny oraz koniczyny czerwonej. Średnie zagęszczenie (tj. liczba osobników na 1 hektarze) Apoidea – nadrodziny owadów obejmującej pszczoły oraz grzebacze na terenach ruderalnych wynosi 887,6, natomiast w obrębie lasów – 497,7, co oznacza, że na obszarach uznawanych powszechnie za nieużytki żyje średnio 1,8 razy więcej owadów błonkoskrzydłych niż w lasach [21]. Zmiana zagospodarowywania gruntów, tj. stopniowe zmniejszanie powierzchni łąk i pastwisk, sukcesja wtórna, a także adaptacja terenów ruderalnych pod zabudowę, również może oddziaływać negatywnie na populację dzikich owadów zapylających poprzez zmniejszanie dostępnej bazy pokarmowej. Ta jest często związana z obecnością w krajobrazie gatunków utożsamianych z chwastami roślin uprawnych, zwłaszcza w przypadku zapylaczy wyspecjalizowanych pokarmowo (zbierających pyłek z określonych gatunków).

Interesującą przedstawicielką pszczół samotnic jest zagrożona wyginięciem murarka powojówka Hoplitis papaveris, zwana również makową. Choć nie jest ona wyspecjalizowana pokarmowo, najchętniej korzysta z pyłku astrowatych Astraceae, powoju polnego Convolvulus arvensis L. oraz dzwonków Campanula, natomiast płatki maku polnego oraz innych gatunków utożsamianych z chwastami pól uprawnych (m.in. bodziszka drobnego Geranium pusillum L. oraz chabra bławatka Centaurea cyanus L.) służą jej do wykładania gniazda [27]. Z perspektywy funkcjonowania ekosystemów nieprawidłowe jest zatem sformułowanie „chwasty”. Stosując herbicydy, by zapobiec gatunkom segetalnym w uprawach, często pozbawiamy dzikie zapylacze bazy pokarmowej, a niekiedy także materiałów służących budowie gniazda, czy stanowiących miejsce gniazdowania (m.in. lepiarki i murarki).
Sytuacja pszczoły miodnej
By określić stan liczebny pszczoły miodnej, stosuje się wskaźnik napszczelenia będący ilorazem ilości rodzin pszczelich przypadających na jednostkę terenu (km2) [28]. Wartość wskaźnika powyżej 7 informuje o przepszczeleniu (zbyt dużej ilości pasiek na 1 km2). Przyjrzyjmy się jak zmieniała się wartość wskaźnika napszczelenia pszczołą miodną w latach 2012-2021. Kolorem zielonym oznaczono wartości wskaźnika poniżej 5, żółtym – powyżej 5 i czerwonym – powyżej 7.
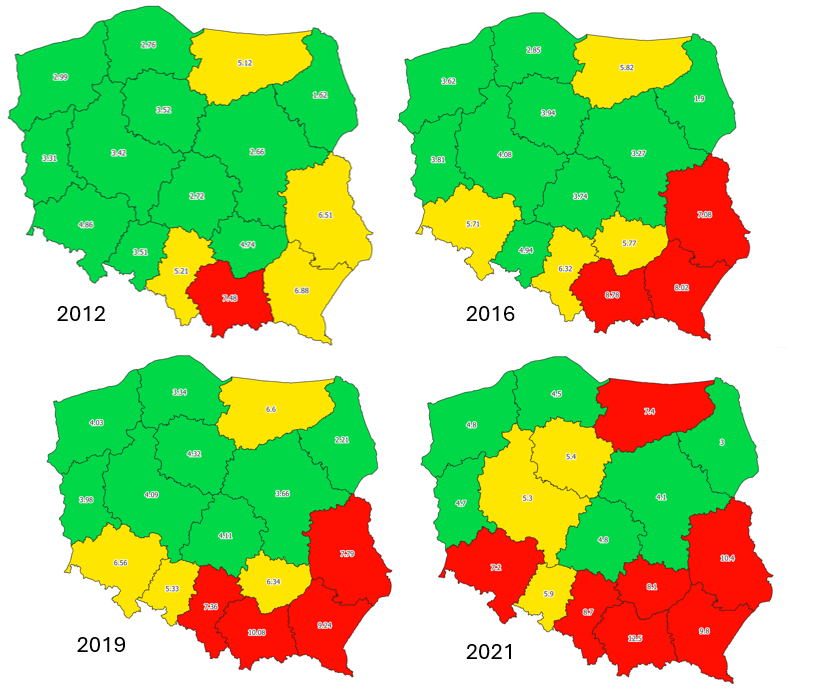
W 2012 roku zbyt wysoką liczbę pasiek na 1 km2 zidentyfikowano w jednym województwie, podczas, gdy w 2021 dotkniętych przepszczeleniem było już 7 województw. Jednocześnie we wszystkich województwach w ostatnich latach obserwowany jest stopniowy wzrost wskaźnika napszczelenia [29,30], a Polska jest drugim największym producentem miodu na świecie [29]. Nadmiar pszczoły miodnej paradoksalnie może zagrażać uprawom i wysokości plonowania. Większa liczebność rodzin pszczelich przy niedostatecznej bazie pokarmowej wzmaga konkurencję o zasoby, zagrażając głównie dzikim zapylaczom, które często pracują w warunkach pogodowych, w których pszczoła miodna nie jest aktywna. Ma to szczególne znaczenie, choćby w przypadku niskich wczesnowiosennych porannych temperatur, które często towarzyszą kwitnieniu upraw sadowniczych. Jednym ze skutecznych w zapylaniu gatunków pszczół jest murarka ogrodowa Osmia rufa, która rozpoczyna obloty z początkiem kwietnia, wykazując jednocześnie w całym okresie aktywności dużą ruchliwość na odwiedzanych przez siebie kwiatach [12]. Populacja pszczoły miodnej w naszym kraju nie jest zagrożona. Tak jak w przypadku pozostałych zapylaczy, powinniśmy dbać o jej dobrostan, jednak nie należy zaliczać pszczoły miodnej do zapylaczy zagrożonych wyginięciem. Badania naukowe podkreślają jednocześnie, że troska o populację zapylaczy nie powinna być postrzegana jako stawianie miejskich pasiek. Przynosi to bowiem negatywne środowiskowo skutki, zwiększając konkurencję o zasoby pokarmowe. Pszczoły miodne nie mogą także zastąpić funkcji pełnionych przez dzikie pszczoły, odwiedzając znacznie mniej gatunków roślin dzikich, preferują jedynie gatunki uprawiane i nasadzane w miejskich rabatach. Przeprowadzone w Paryżu badania wskazują, że im wyższe jest zagęszczenie populacji pszczół miodnych na terenie miasta, tym niższa jest wartość wskaźnika odwiedzin dzikich zapylaczy [30]. Neguje to powszechne przekonanie (panujące także w Polsce) o konieczności rozwoju sektora pszczelarstwa miejskiego w kontekście jego ochronnego wpływu na bioróżnorodność.
Odrębną kwestią pozostaje jakość pożytków pszczelich pozyskiwanych z miejskich pasiek. Choć dotychczas otrzymane wyniki wskazują, że tzw. miód miejski nie jest zanieczyszczony metalami ciężkimi bardziej niż ten pochodzący z terenów peryferyjnych [31], zawartość związków przeciwutleniających w miodzie z miejskich pasiek jest znacznie niższa niż w tzw. miodzie wiejskim. Potencjał antyoksydacyjny determinowany jest przez zawartość polifenoli w tkankach roślinnych. Ta zaś zależy m.in. od warunków klimatycznych, glebowych, agrotechnicznych oraz wodnych. W warunkach miasta kumulowaniu polifenoli, wykazujących działanie przeciwnowotworowe, nie sprzyja m.in. stosowanie wyłącznie nawozów sztucznych, zasolenie gleby (zwłaszcza na terenach z funkcjonującym przemysłem hutniczym i górniczym) oraz wyższa, panująca w miejskich wyspach ciepła: wilgotność powietrza; kumulacja polifenoli następuje w warunkach, gdy rośliny narażone są na stres suszy. Autorzy przytoczonych powyżej badań wskazują, że spożywanie miodu miejskiego w celach profilaktycznych (zwłaszcza tych o podłożu antyutleniającym) należy dokładnie rozważyć [32].
Ochrona (wszystkich) zapylaczy
Do działań, które mogą wesprzeć populację zapylaczy należą przede wszystkim:
- ograniczanie zużycia chemicznych środków ochrony roślin,
- zachowywanie miedz, zadrzewień śródpolnych i stref buforowych,
- utrzymywanie łąk i pastwisk,
- wysiewanie i nasadzanie rodzimych gatunków roślin i zwiększanie dostępności kwiatów w krajobrazie z uwzględnieniem zapewnienia stałości pożytku (przez cały okres wegetacyjny; od wczesnej wiosny do późnej jesieni) – także na obszarach miast,
- zmniejszanie udziału wielohektarowych monokultur,
- edukacja (w tym szczególnie dot. beewashingu),
- zmiany na poziomie legislacyjnym (organizacja na terenach chronionych stref wolnych od utrzymywanej w chowie pszczoły miodnej tj. zakazy lokowania pasiek na obszarach objętych formami ochrony przyrody) [33].
Literatura:
- Yakymchuk A., Dlaczego ocena różnorodności biologicznej jest ważna i jakie ma ona zastosowanie w naszym codziennym życiu. Zielony Blog WSIiZ (18.07.2024)
- Majewski J., 2016. Ekonomiczna wycena roli owadów zapylających w polskim rolnictwie. [W:] K. Prandecki (red.), Z badań nad rolnictwem społecznie zrównoważonym. Internalizacja efektów zewnętrznych w rolnictwie – europejskie doświadczenia, s. 80–97, Warszawa
- European Red List of Bees Link: https://portals.iucn.org/library/sites/library/files/documents/RL-4-019.pdf
- Cleiton G. Rodrigues, Alexandra P. Krüger, Wagner F. Barbosa, Raul Narciso C. Guedes, 2016: Leaf Fertilizers Affect Survival and Behavior of the Neotropical Stingless Bee Friesella schrottkyi (Meliponini: Apidae: Hymenoptera). Journal of Economic Entomology, t. 109, wyd. III, s. 1001–1008 Link: https://doi.org/10.1093/jee/tow044
- Steinhübel, L., Wenzel, A., Hulamani, P. et al. 2022: Effects of local farm management on wild bees through temporal and spatial spillovers: evidence from Southern India. Landsc Ecol 37, 2635–2649 Link: https://doi.org/10.1007/s10980-022-01507-8
- Siede R., Dyrba W., Augustin T., Wiegand A., Ellinghaus R., 2013: Boron fertilizers in rape – a risk for honey bees? Journal of applied entomology.
- Hunting E. R., England S. J., Koh K., Lawson D.A., Brun N. R., Robert D., 2022: Synthetic fertilizers alter floral biophysical cues and bumblebee foraging behawior. PNAS Nexus, 2022, 1, 1–6. Research Report. Link: https://doi.org/10.1093/pnasnexus/pgac230
- Dubicka A., Czechowski P., 2022: Trzmiele (Bombus) i trzmielce (Psithyrus) województwa lubuskiego. [W:] S. Pilichowski (red.), Bezgraniczny skarb. Ochrona przyrody polsko-niemieckiego pogranicza., s. 77-87
- https://www.europarl.europa.eu/topics/pl/article/20191129STO67758/co-powoduje-spadek-liczebnosci-pszczol-i-innych-zapylaczy-infografiki
- https://ec.europa.eu/commission/presscorner/detail/pl/MEMO_18_3990
- Banaszak J., Cierzniak T., 1995: Ekonomiczne efekty zapylania roślin uprawnych przez pszczołę miodną i dziko żyjące pszczołowate (Apoidea). Polskie Towarzystwo Przyrodników im. Kopernika. KOSMOS. 44(1):47-61
- Teper D., Borański M., 2017: Hodowla pszczół samotnic sposobem na uzupełnienie niedoborów zapylaczy. In Hort. Instytut Ogrodnictwa. Zakład Pszczelnictwa w Puławach. Pracownia Zapylania Roślin.
- Burkot P., 2022: Różnorodność gatunkowa zapylaczy. Poznaj – Polubisz. Przez poznanie lokalnych gatunków do poszerzania wiedzy i umiejętności biologicznych uczniów. EBiŚ, 1(77) za: Lipiński M., 1982: Pożytki pszczele zapylanie i miododajność roślin. Warszawa: Państwowe Wydawnictwo Rolnicze i Leśne.
- Wasilewska E., Kęsy M., 2019. Znaczenie pszczół (Apoidea) w życiu człowieka. [W:] H. Mamzer, A. Żok. (red.), Bezpieczne czy zniewolone? Szkice o zwierzętach., s. 169-175
- Banaszak J., Cierzniak T., 2000: Ocena stopnia zagrożeń i możliwości ochrony owadów w agroekosystemach, „Wiadomości Entomologiczne”, Poznań 2000, 18, Supl. 2, s. 73-94.
- European Red List of Bees Link: https://portals.iucn.org/library/sites/library/files/documents/RL-4-019.pdf
- Beewashing – zagrożenie dla pszczół i bioróżnorodności Link:https://kwietna.org/2022/11/30/beewashing-zagrozenie-dla-pszczol-i-bioroznorodnosci/
- https://pap-mediaroom.pl/biznes-i-finanse/zielone-fermy-wipasz-sa-odchowuja-kurczeta-bez-antybiotykow-i-gmo
- Colla S.R., 2022: The potential consequences of ‘bee washing’ on wild bee health and conservation The potential consequences of ‘bee washing’ on wild bee health and conservation. International Journal for Parasitology: Parasites and Wildlife, Volume 18, Pages 30-32, ISSN 2213-2244, Link: https://doi.org/10.1016/j.ijppaw.2022.03.011.
- Siuda M., Wilde J., Bratkowski J., 2002: Korzyści użytkowania pszczół opornych na choroby w pasiekach. Biuletyn Naukowy Nr 18. Link: https://www.researchgate.net/publication/242603991
- Banaszak J., Czechowska W., Czechowski W., Garbarczyk H., Sanowiewicz J., Wiśniowski B., 2000: Zagrożenia i perspektywy ochrony owadów błonkoskrzydłych. Wiadomości Entomologiczne. Nr 18/2, s. 177-211, Poznań
- Piot N., Schweiger O., Meeus I., Yanez O., Straub L., Villamar-Bouza L., De la Rúa P., Jara L., Ruiz C., Malmstrøm M., Mustafa S., 2022. Honey bees and climate explain viral prevalence in wild bee communities on a continental scale. Sci. Rep. 12 (1), s.1–11
- https://kwietna.org/2024/05/16/korporacyjny-beewashing-kwitnie-za-duzo-pszczol-w-polskich-miastach/
- Angelella G. M., McCullough C. T., O’Rourke M. E.: Honey bee hives decrease wild bee abundance, species richness, and fruit count on farms regardless of wildflower strips. Scientific Reports Link: https://www.nature.com/articles/s41598-021-81967-1
- Starosta M., 2024: Opryski z powietrza w polskich lasach. Analiza Prawna. Wyd.: ClientEarth. Prawnicy dla Ziemi, Warszawa Link: Vhttps://www.clientearth.pl/media/bb5f5itg/2024-04-15-opryski-z-powietrza-w-polskich-lasach-analiza-prawna-clientearth.pdf
- Main, A. R., Webb, E. B., Goyne, K. W. & Mengel, D. (2018). Neonicotinoid insecticides negatively affect performance measures of non-target terrestrial arthropods: A meta-analysis. Ecol. Appl 28, 1232–1244; Van der Sluijs, J. P. (2020). Insect decline, an emerging global environmental risk. Curr. Opin. Environ. Sustain. 46, 39–42.
- https://insektarium.net/hymenoptera-2/megachilidae-miesierkowate/hoplitis-papaveris-murarka-powojowka/
- Kobylińska M., 2020: Regionalne zróżnicowanie pszczelarstwa w Polsce
- Semkiw P., 2021: Sektor pszczelarski w Polsce w 2021 roku
- Ropars L., Dajoz I., Fontaine C., Muratet A., Geslin B., 2019: Wild pollinator activity negatively related to honey bee colony densities in urban context. PLoS ONE 14(9). Link: https://doi.org/10.1371/journal.pone.0222316
- Sadowska, M., Gogolewska, H., Pawelec, N., Sentkowska, A., Krasnodębska-Ostręga B., 2019: Comparison of the contents of selected elements and pesticides in honey bees with regard to their habitat. Environ. Sci. Pollut. Res. 26, s. 371–380
- Nicewicz A. W., Nicewicz Ł., Pawłowska, P. 2021: Antioxidant capacity of honey from the urban apiary: a comparison with honey from the rural apiary. Sci Rep 11, 9695 Link: https://doi.org/10.1038/s41598-021-89178-4
- https://schleswig-holstein.nabu.de/tiere-und-pflanzen/insekten/wespen/19172.html
Skontaktuj się z nami
Chcesz podzielić się przemyśleniami, do których zainspirował Cię artykuł, zainteresować nas ważną sprawą lub opowiedzieć swoją historię? Napisz do redakcji na adres:
mgr inż. Natalia Guz
Asystentka w Biurze Zrównoważonego Rozwoju WSIiZ. Z wykształcenia geografka, agroleśniczka i florystka. Jej zainteresowania naukowe koncentrują się na hydrologii i zrównoważonym zarządzaniu zasobami wody, etnobotanice, botanice stosowanej, a także bioindykacji i rolnictwie polikulturowym.
